Resumen
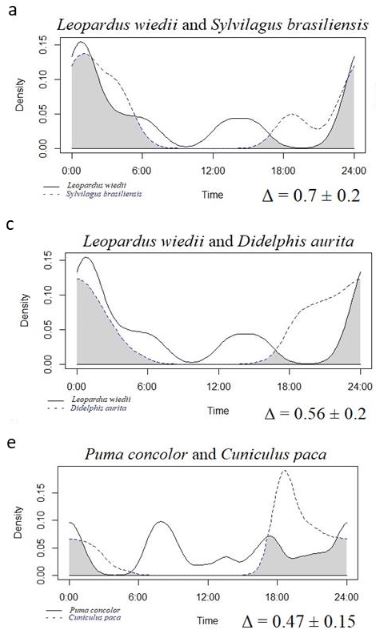
El tiempo y el espacio son dimensiones de nicho que permiten la coexistencia de depredadores y sus presas. Los patrones de actividad son un componente crucial de la ecología y el comportamiento de los mamíferos, y la evitación temporal a menudo se considera el mecanismo más importante de coexistencia entre especies. Sin embargo, la superposición temporal por sí sola no define la vulnerabilidad de la presa o la preferencia del depredador, ya que también debe haber segregación espacial, lo que puede aliviar posibles interacciones hostiles entre animales. En este estudio, probamos si existen diferencias entre los patrones de actividad temporal y espacial de los depredadores (Leopardus wiedii y Puma concolor) y las presas (Sylvilagus brasiliensis, Cuniculus paca y Didelphis aurita). Usamos los datos de las cámaras trampa para probar si la especie del depredador tuvo menos ocurrencia de lo esperado por casualidad en el Parque Nacional da Serra dos Órgãos (PARNASO), un área protegida del Bosque Atlántico brasileño. Usamos una medida de segregación espacial (puntuación C) y una función de densidad del núcleo para determinar el tiempo de actividad de los depredadores y las presas y si un par de especies ocurrieron simultáneamente. Además, calculamos un coeficiente de superposición entre depredadores y presas. Encontramos valores bajos de C-Score en todos los análisis, lo que significa una alta co-ocurrencia espacial y falta de segregación espacial entre los depredadores y sus presas potenciales. Además, la función de densidad del núcleo mostró que los depredadores tenían más actividad catemeral mientras que las presas eran principalmente nocturnas. Mostramos así que la segregación temporal es más importante que la segregación espacial en el área de estudio. Nuestros resultados sugieren que es más probable que los depredadores ajusten sus patrones de actividad en función del comportamiento de su presa principal en lugar de evitar la competencia.
Citas
Bianchi, R. D. C., Olifiers, N., Gompper, M. E. & Mourão, G. (2016). Niche partitioning among mesocarnivores in a Brazilian wetland. PLoS One, 11(9), e0162893.
Botts, R. T., Eppert, A. A., Wiegman, T. J., Rodriguez, A., Blankenship, S. R., Asselin, E. M., ... & Mooring, M. S. (2020). Circadian activity patterns of mammalian predators and prey in Costa Rica. Journal of mammalogy, 101(5), 1313-1331. https://doi.org/10.1093/jmammal/gyaa103
Castillo-Ruiz, A., Paul, M. J. & Schwartz, J. (2012). In search of a temporal niche: social interactions. Progress in Brain Research 199: 267–280.
Contreras-Díaz, C. A., Soria-Díaz, L., Gómez-Ortiz, Y., Carrera-Treviño, R., Astudillo-Sánchez, C. C., Chacón-Hernández, J. C., & Martínez-García, L. (2021). Temporal and spatial segregation of top predators (Felidae) in a Mexican tropical Biosphere Reserve. Zoologia (Curitiba), 38. https://doi.org/10.3897/zoologia.38.e63231
Currier, M. J. P. (1983). Felis concolor. Mammalian species, (200), 1-7. https://doi.org/10.2307/3503951
De Oliveira, T. G. (2002). Comparative feeding ecology of jaguar and puma in the Neotropics. Pp. 265–288 in El jaguar en el nuevo milenio (R. A. Medellín et al., eds.). Fondo de Cultura Económica, Universidad Nacional Autónoma de México, Wildlife Conservation Society. México, D.F., México.
Di Bitetti, M. S., De Angelo, C. D., Di Blanco, Y. E. & Paviolo, A. (2010). Niche partitioning and species coexistence in a Neotropical felid assemblage. Acta Oecologica, 36(4), 403-412. https://doi.org/10.1016/j.actao.2010.04.001
Emmons, L. H. (1989). Jaguar predation on chelonians. Journal of Herpetology, 23(3), 311-314. https://doi.org/10.2307/1564460
Eriksen, A., Wabakken, P., Zimmermann, B., Andreassen, H. P., Arnemo, J. M., Gundersen, H., ... & Storaas, T. (2011). Activity patterns of predator and prey: a simultaneous study of GPS-collared wolves and moose. Animal Behaviour, 81(2), 423-431. https://doi.org/10.1016/j.anbehav.2010.11.011
Figueiredo, M. D. S. L., Weber, M. M., Brasileiro, C. A., Cerqueira, R., Grelle, C. E., Jenkins, C. N., ... & Lorini, M. L. (2021). Tetrapod diversity in the Atlantic Forest: maps and gaps. In The Atlantic Forest (pp. 185-204). Springer, Cham. https://doi.org/10.1007/978-3-030-55322-7_9
Foster, V. C., Sarmento, P., Sollmann, R., Tôrres, N., Jácomo, A. T., Negrões, N., ... & Silveira, L. (2013). Jaguar and puma activity patterns and predator‐prey interactions in four Brazilian biomes. Biotropica, 45(3), 373-379. https://doi.org/10.1111/btp.12021
Gotelli, N. J., Hart, E. M. & Ellison, A. M. (2015). Co-occurrence analysis. EcoSim R.
Goulart, F. V. B., Cáceres, N. C., Graipel, M. E., Tortato, M. A., Ghizoni Jr, I. R. & Oliveira-Santos, L. G. R. (2009). Habitat selection by large mammals in a southern Brazilian Atlantic Forest. Mammalian Biology, 74(3), 182-190. https://doi.org/10.1016/j.mambio.2009.02.006
Guiden, P. W., Bartel, S. L., Byer, N. W., Shipley, A. A. & Orrock, J. L. (2019). Predator–prey interactions in the Anthropocene: reconciling multiple aspects of novelty. Trends in ecology & evolution, 34(7), 616-627. https://doi.org/10.1016/j.tree.2019.02.017
Harmsen, B. J., Foster, R. J., Silver, S. C., Ostro, L. E., & Doncaster, C. P. (2011). Jaguar and puma activity patterns in relation to their main prey. Mammalian Biology, 76(3), 320-324. https://doi.org/10.1016/j.mambio.2010.08.007
Hertel, A. G., Swenson, J. E. & Bischof, R. (2017). A case for considering individual variation in diel activity patterns. Behavioral Ecology 28: 1524–1531. https://doi.org/10.1093/beheco/arx122
Hut, R. A., Kronfeld-Schor, N., van der Vinne, V. & De la Iglesia, H. (2012). In search of a temporal niche: environmental factors. Progress in brain research, 199, 281-304.
Lima, S. L. (2002). Putting predators back into behavioral predator– prey interactions. Trends in Ecology and Evolution 17: 70–75. https://doi.org/10.1016/s0169-5347(01)02393-x
Lira, P. K., Portela, R. D. C. Q. & Tambosi, L. R. (2021). Land-Cover Changes and an Uncertain Future: Will the Brazilian Atlantic Forest Lose the Chance to Become a Hopespot?. In The Atlantic Forest (pp. 233-251). Springer, Cham. https://doi.org/10.1007/978-3-030-55322-7_11
MacArthur, R. H. & Pianka, E. R. (1966). On optimal use of a patchy environment. The American Naturalist, 100(916), 603-609. https://doi.org/10.1086/282454
Marinho, P. H., Bezerra, D., Antongiovanni, M., Fonseca, C. R. & Venticinque, E. M. (2018). Mamíferos de médio e grande porte da caatinga do Rio Grande do Norte, nordeste do Brasil. Mastozoología Neotropical, 25(2), 345-362. https://doi.org/10.31687/saremmn.18.25.2.0.15
Marinho, P. H., Fonseca, C. R., Sarmento, P., Fonseca, C. & Venticinque, E. M. (2020). Temporal niche overlap among mesocarnivores in a Caatinga dry forest. European Journal of Wildlife Research, 66(2), 1-13. https://doi.org/10.1007/s10344-020-1371-6
Massara, R. L., de Oliveira Paschoal, A. M., Bailey, L. L., Doherty Jr, P. F., de Frias Barreto, M. & Chiarello, A. G. (2018). Effect of humans and pumas on the temporal activity of ocelots in protected areas of Atlantic Forest. Mammalian Biology, 92, 86-93. https://doi.org/10.1016/j.mambio.2018.04.009
McBee, K. & Baker, R. J. (1982). Dasypus novemcinctus. Mammalian species, (162), 1-9. https://doi.org/10.2307/3503864
Meredith, M. & Ridout, M. (2021). Overview of the overlap package, https://cran.r-project.org/web/packages/overlap/vignettes/overlap.pdf
Nagy-Reis, M. B., Nichols, J. D., Chiarello, A. G., Ribeiro, M. C. & Setz, E. Z. (2017). Landscape use and co-occurrence patterns of Neotropical spotted cats. PloS one, 12(1), e0168441. https://doi.org/10.1371/journal.pone.0168441
Núñez, R., Miller, B. & Lindzey, F. (2000). Food habits of jaguars and pumas in Jalisco, Mexico. Journal of Zoology, 252(3), 373-379. https://doi.org/10.1017/s095283690000011x
Polis, G. A., Myers, C. A. & Holt, R. D. (1989). The ecology and evolution of intraguild predation: potential competitors that eat each other. Annual review of ecology and systematics, 20(1), 297-330. https://doi.org/10.1146/annurev.es.20.110189.001501
Ribeiro, M. C., Metzger, J. P., Martensen, A. C., Ponzoni, F. J. & Hirota, M. M. (2009). The Brazilian Atlantic Forest: How much is left, and how is the remaining forest distributed? Implications for conservation. Biological conservation, 142(6), 1141-1153. https://doi.org/10.1016/j.biocon.2009.02.021
Ridout, M. & Linkie, M. (2009). “Estimating overlap of daily activity patterns from camera trap data.” Journal of Agricultural, Biological, and Environmental Statistics, 14(3), 322–337.
Schoener, T. W. (1974). Resource partitioning in ecological communities. Science, 185(4145), 27-39. https://doi.org/10.1126/science.185.4145.27
Scognamillo, D., Maxit, I. E., Sunquist, M. & Polisar, J. (2003). Coexistence of jaguar (Panthera onca) and puma (Puma concolor) in a mosaic landscape in the Venezuelan llanos. Journal of Zoology, 259(3), 269-279. https://doi.org/10.1017/s0952836902003230
Smythe, N. (1987). The importance of mammals in Neotropical forest management. Management of the forests of tropical America: prospects and technologies, 79-98.
Souza, C. M., Z Shimbo, J., Rosa, M. R., Parente, L. L., A Alencar, A., Rudorff, B. F., ... & Azevedo, T. (2020). Reconstructing three decades of land use and land cover changes in brazilian biomes with landsat archive and earth engine. Remote Sensing, 12(17), 2735.
Varzinczak, L. H., Bernardi, I. P. & Passos, F. C. (2016). Null model analysis on bat species co-occurrence and nestedness patterns in a region of the Atlantic Rainforest, Brazil. Mammalia, 80(2), 171-179. https://doi.org/10.1515/mammalia-2014-0117
Weckel, M., Giuliano, W., Silver, S. (2006). Jaguar (Panthera onca) feeding ecology: distribution of predator and prey through time and space. J. Zool. 270, 25–30. https://doi.org/10.1111/j.1469-7998.2006.00106.x